Dette er et søkefelt med autofullføringsforslag. Start å skrive og du vil få opp forslag på virkestoff, legemidler og bruksområder, som du kan velge mellom. Bruk Søke-knappen hvis autofullføringsforslagene ikke er relevante, eller Strekkode-knappen hvis du ønsker å skanne strekkoden på legemiddelpakningen.
Aimovig
Migrenemiddel, CGRP-hemmer, monoklonalt humant antistoff (IgG2).
INJEKSJONSVÆSKE, oppløsning i ferdigfylt penn 70 mg og 140 mg: Hver ferdigfylte penn inneh.: Erenumab 70 mg, resp. 140 mg, sukrose, polysorbat 80, natriumhydroksid, eddiksyre, vann til injeksjonsvæsker.
Dosering
Mht. sporbarhet skal preparatnavn og batchnr. noteres i pasientjournalen. Behandling bør initieres av lege med erfaring i diagnostisering og behandling av migrene.
Voksne
Anbefalt dose er 70 mg hver 4. uke. Noen pasienter kan ha bedre effekt av 140 mg (enten som 1 s.c. injeksjon à 140 mg eller som 2 s.c. injeksjoner à 70 mg) hver 4. uke. Klinisk effekt oppnås oftest etter 3 måneder. Ved manglende respons etter 3 måneder bør behandlingsavbrudd vurderes. Evaluer deretter behovet for å fortsette behandlingen regelmessig.
Spesielle pasientgrupper
- Nedsatt leverfunksjon: Dosejustering ikke nødvendig.
- Nedsatt nyrefunksjon: Dosejustering ikke nødvendig ved lett til moderat nedsatt nyrefunksjon.
- Barn og ungdom <18 år: Sikkerhet og effekt ikke fastslått, ingen data.
- Eldre ≥65 år: Dosejustering ikke nødvendig.
Tilberedning/Håndtering Se pakningsvedlegg. Til engangsbruk. Skal ikke ristes. Bør være i romtemperatur (<25°C) i minst 30 minutter før injeksjon for å unngå ubehag på injeksjonsstedet. Skal ikke varmes opp ved bruk av varmekilder som varmt vann eller mikrobølgeovn. Bør beskyttes mot direkte sollys. Sjekkes visuelt før bruk. Skal ikke injiseres hvis uklar, tydelig gul eller inneholder flak eller partikler. Blandbarhet: Skal ikke blandes med andre legemidler pga. manglende data.
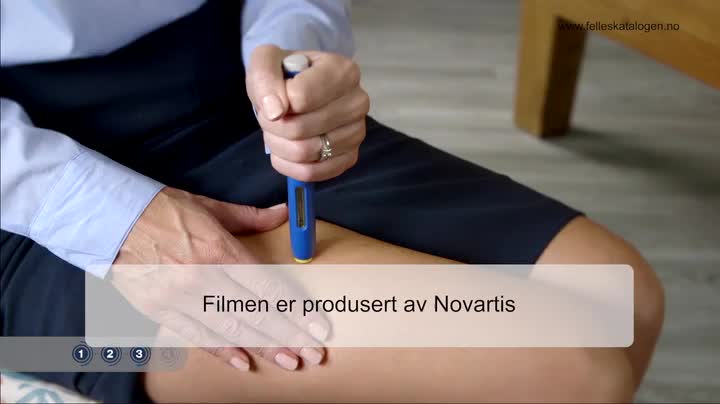
Administrering Injiseres s.c., se bruksanvisning i pakningsvedlegget. Beregnet for selvadministrering av pasienten etter tilstrekkelig opplæring. Kan også injiseres av en annen person med tilstrekkelig opplæring. Injiseres i abdomen, låret eller i ytre del av overarmen (skal kun brukes hvis injeksjonen settes av en annen enn pasienten). Injiser hele innholdet. Injeksjonsstedene skal byttes på, og skal ikke settes i områder hvor huden er øm, har blåmerker, er rød eller hard.
Forsiktighetsregler
Hjerte/kar: Sikkerhetsdata mangler ved enkelte alvorlige kardiovaskulære sykdommer (pasienter med preeksisterende hjerteinfarkt, slag, TIA, ustabil angina, koronar bypass-operasjon eller andre revaskuleringsprosedyrer innenfor 12 måneder), se SPC for ytterligere informasjon. Overfølsomhetsreaksjoner: Alvorlige overfølsomhetsreaksjoner, inkl. utslett, angioødem og anafylaktiske reaksjoner, er sett. Kan inntreffe i løpet av få minutter, men også >1 uke etter behandling. Pasienten skal derfor advares om symptomer på overfølsomhetsreaksjoner. Ved kraftig/alvorlig overfølsomhetsreaksjon skal egnet behandling startes og erenumabbehandlingen avbrytes. Forstoppelse: Vanligvis av mild eller moderat intensitet. Går i de fleste tilfeller over innen 3 måneder. Forstoppelse med alvorlige komplikasjoner er rapportert, inkl. tilfeller der sykehusinnleggelse og kirurgi var nødvendig. Forstoppelse i anamnesen eller samtidig bruk av legemidler som nedsetter gastrointestinal motilitet, kan øke risikoen for mer alvorlig forstoppelse og komplikasjoner. Pasienten bør advares om risikoen for forstoppelse og rådes til å oppsøke lege hvis forstoppelsen ikke går over eller blir verre. Ved alvorlig forstoppelse bør pasienten umiddelbart oppsøke lege. Forstoppelse bør håndteres raskt som klinisk hensiktsmessig, og ved alvorlig forstoppelse bør seponering av behandlingen vurderes. Hjelpestoffer: Natrium: Inneholder <1 mmol (23 mg) natrium pr. dose, og er så godt som natriumfritt. Polysorbat 80: Inneholder <0,1 mg pr. ml (0,004 mg/kg). Bilkjøring og bruk av maskiner: Ingen/ubetydelig påvirkning på evnen til å kjøre bil eller bruke maskiner.Interaksjoner
Graviditet, amming og fertilitet
GraviditetBegrensede data. Dyrestudier viser ingen direkte eller indirekte skadelige reproduksjonseffekter. Det anbefales som et forsiktighetstiltak å unngå bruk under graviditet.
AmmingOvergang i morsmelk er ukjent. Human IgG utskilles i morsmelk i løpet av de første dagene etter fødselen, og avtar til lave nivåer kort tid etterpå. Risiko for spedbarnet kan derfor ikke utelukkes i denne korte perioden. Bruk av erenumab kan deretter vurderes under amming hvis klinisk nødvendig.
FertilitetDyrestudier viser ingen effekt på fertilitet.
Bivirkninger
Frekvensintervaller: Svært vanlige (≥1/10), vanlige (≥1/100 til <1/10), mindre vanlige (≥1/1000 til <1/100), sjeldne (≥1/10 000 til <1/1000), svært sjeldne (<1/10 000) og ukjent frekvens.
Overdosering/Forgiftning
BehandlingSymptomatisk behandling og støttende tiltak gis etter behov.
Egenskaper og miljø
VirkningsmekanismePotent og spesifikk kompetitor til kalsitonin-genrelatert peptid (CGRP), og inhiberer CGRPs virkning på CGRP-reseptorer. CGRP er et nevropeptid som modulerer nociseptiv signalering og en vasodilatator assosiert til migrenens patofysiologi.
AbsorpsjonCmax nås 4-6 dager etter enkeltdose. Biotilgjengelighet: 82%.
FordelingVd etter 140 mg gitt i.v.: 3,86 liter.
Halveringstid28 dager.
Pakninger, priser og refusjon
Aimovig, INJEKSJONSVÆSKE, oppløsning i ferdigfylt penn:
| Styrke | Pakning Varenr. |
Refusjon | Pris (kr) | R.gr. |
|---|---|---|---|---|
| 70 mg | 1 ml (ferdigfylt penn) 568054 |
- |
3 347,20 | C |
| 3 × 1 ml (ferdigfylt penn) 430610 |
- |
9 969,10 | C | |
| 140 mg | 1 ml (ferdigfylt penn) 189312 |
- |
3 347,20 | C |
| 3 × 1 ml (ferdigfylt penn) 421870 |
- |
9 969,10 | C |
Individuell stønad
Erenumab
Legemidler: Aimovig injeksjonsvæske
Indikasjon: Forebyggende behandling av kronisk migrene.
For blåreseptsøknad og -vedtak, se Tjenesteportal for helseaktører
SPC (preparatomtale)
Aimovig INJEKSJONSVÆSKE, oppløsning i ferdigfylt penn 70 mg Aimovig INJEKSJONSVÆSKE, oppløsning i ferdigfylt penn 140 mg |
Basert på SPC godkjent av DMP/EMA:
01.12.2025
Sist endret: 13.01.2026
(priser og ev. refusjon oppdateres hver 14. dag)